- Outeur Alex Aldridge aldridge@what-difference.com.
- Public 2023-12-17 13:31.
- Laas verander 2025-06-01 07:36.
Die sleutelverskil tussen koolsuur en bikarbonaat is dat koolsuur 'n neutrale chemiese verbinding is, terwyl bikarbonaat 'n negatief gelaaide chemiese verbinding is.
Koolstofsuur is 'n swak suur wat in oplossing vorm wanneer koolstofdioksied in water oplos, met die chemiese formule H2CO3. Bikarbonaat vorm deur die kombinasie van drie suurstofatome, 'n waterstofatoom en 'n koolstofatoom met die chemiese formule HCO3-.
Wat is koolsuur?
Koolstofsuur is H2CO3. Soms gee ons hierdie naam aan oplossings met koolstofdioksied opgelos in water of koolzuurhoudende water. Dit is omdat koolzuurhoudende water 'n klein hoeveelheid H2CO3 bevat. Verder is koolsuur 'n swak suur, en dit kan twee tipes soute soos karbonate en bikarbonate vorm. Die molêre massa van hierdie verbinding is 62,024 g/mol.
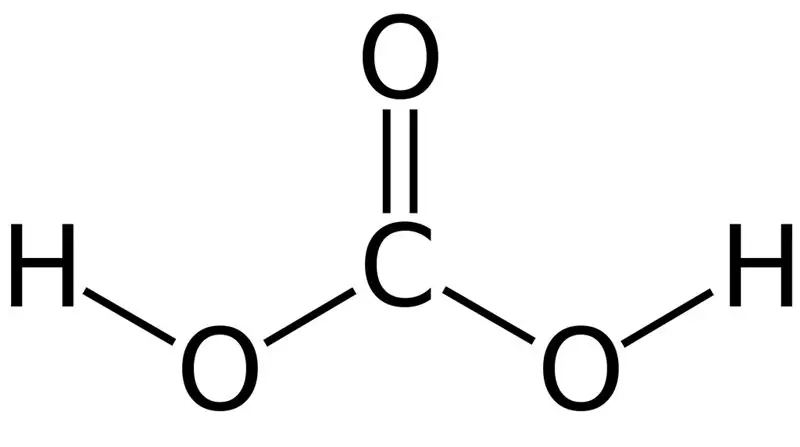
Figuur 01: Die chemiese struktuur van koolsuur
Wanneer koolstofdioksied in water oplos, kom dit in 'n ewewig tussen koolstofdioksied en koolsuur. Die ewewig is soos volg:
CO2 + H2O ⟷ H2CO3
As ons 'n oormaat koolsuur by 'n basis voeg, gee dit bikarbonaat. Maar as daar 'n oormaat basis is, is koolsuur geneig om koolzuurhoudende soute te gee. Meer presies, koolsuur is 'n karboksielsuurverbinding wat twee hidroksielgroepsubstituente aan die karbonielkoolstof het. Boonop is dit 'n poliprotiese suur wat in staat is om protone te skenk. Dit het twee verwyderbare protone, so dit is spesifiek diproties.
Wat is Bikarbonaat?
Bikarbonaat vorm deur die kombinasie van drie suurstofatome, 'n waterstofatoom en 'n koolstofatoom. Die produk van hierdie kombinasie kan 'n ioon of 'n verbinding met meer elektrone as protone wees. Ons kan dit beskryf as 'n chemiese spesie met die chemiese formule HCO3-.
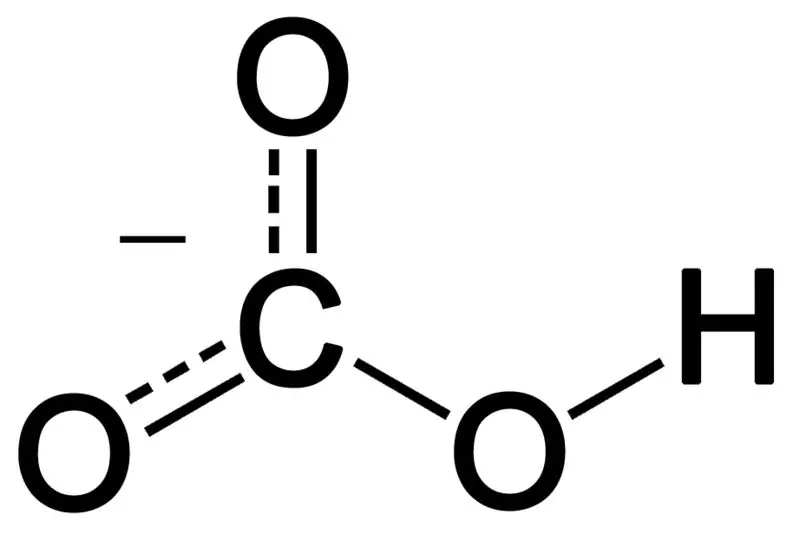
Figuur 02: Die chemiese struktuur van bikarbonaatanioon
Hierdie verbinding is 'n deurslaggewende deel van die liggaam se pH-bufferstelsel, in leketerme: dit is verantwoordelik om 'n mens se bloed in 'n toestand te hou wat nie te suur of te basies is nie. Daarbenewens dien dit as 'n manier om die spysverteringsappe in toom te hou sodra die maag die kos klaar verteer het. Verder vorm koolsuur in reënwater bikarbonaatione wanneer dit rotse tref. Hierdie vloei van bikarbonaatione is belangrik om die koolstofsiklus aan die gang te hou.
Wat is die verskil tussen koolsuur en bikarbonaat?
Koolstofsuur is 'n swak suur wat in oplossing vorm wanneer koolstofdioksied in water oplos, en die chemiese formule daarvan is H2CO3. Bikarbonaat vorm deur die kombinasie van drie suurstofatome, 'n waterstofatoom en 'n koolstofatoom met die chemiese formule HCO3-. Die belangrikste verskil tussen koolsuur en bikarbonaat is dat koolsuur 'n neutrale chemiese verbinding is, terwyl bikarbonaat 'n negatief gelaaide chemiese verbinding is. Koolsuur word boonop gebruik in die maak van borrelende, gaskoeldranke, die behandeling van dermatitiede, in mondspoelmiddel, ens., terwyl bikarbonaat in voedselbereidings soos bak (as 'n rysmiddel) gebruik word, en dit gee die vermoë om veranderinge in pH te weerstaan.
Die volgende infografika som die verskil tussen koolsuur en bikarbonaat in tabelvorm op vir vergelyking langs mekaar.
Opsomming - Koolsuur vs Bikarbonaat
Koolstofsuur is H2CO3. Bikarbonaat vorm deur die kombinasie van drie suurstofatome, 'n waterstofatoom en 'n koolstofatoom, met die chemiese formule HCO3-. Die sleutelverskil tussen koolsuur en bikarbonaat is dat koolsuur 'n neutrale chemiese verbinding is, terwyl bikarbonaat 'n negatief gelaaide chemiese verbinding is.






