- Outeur Alex Aldridge aldridge@what-difference.com.
- Public 2023-12-17 13:31.
- Laas verander 2025-06-01 07:36.
Sleutelverskil - Sterk Ligand vs Swak Ligand
'n Ligand is 'n atoom, ioon of 'n molekule wat twee van sy elektrone skenk of deel deur 'n koördineerde kovalente binding met 'n sentrale atoom of ioon. Die konsep van ligande word onder koördinasiechemie bespreek. Ligande is chemiese spesies wat betrokke is by die vorming van komplekse met metaalione. Daarom staan hulle ook bekend as kompleksvormers. Ligande kan Monodentaat, Bidentaat, Tridentaat, ens. gebaseer wees op die dentisiteit van die ligand. Dentisiteit is die aantal skenkergroepe wat in 'n ligand teenwoordig is. Monodentaat beteken dat ligand slegs een skenkergroep het. Bidentate beteken dat dit twee skenkergroepe per een ligandmolekule het. Daar is twee hooftipes ligande gekategoriseer op grond van kristalveldteorie; sterk ligande (of sterk veld ligande) en swak ligande (of swak veld ligande). Die sleutelverskil tussen sterk ligande en swak ligande is dat die splitsing van orbitale na binding aan 'n sterkveldligand 'n hoër verskil tussen die hoër en laer energievlakorbitale veroorsaak, terwyl die splitsing van orbitale na binding aan 'n swakveldligand 'n laer verskil veroorsaak. tussen die hoër en laer energievlak orbitale.
Wat is Kristalveldteorie?
Kristalleveldteorie kan beskryf word as 'n model wat ontwerp is om die breek van degenerasies (elektronskulpies van gelyke energie) van elektronorbitale (gewoonlik d- of f-orbitale) te verduidelik as gevolg van die statiese elektriese veld wat deur 'n omliggende anioon of anione (of ligande). Hierdie teorie word dikwels gebruik om die gedrag van oorgangsmetaalione-komplekse te demonstreer. Hierdie teorie kan die magnetiese eienskappe, kleure van koördinasiekomplekse, hidrasie-entalpieë, ens.
Teorie:
Die interaksie tussen die metaalioon en ligande is 'n gevolg van die aantrekking tussen die metaalioon met 'n positiewe lading en die negatiewe lading van die ongepaarde elektrone van die ligand. Hierdie teorie is hoofsaaklik gebaseer op die veranderinge wat plaasvind in vyf gedegenereerde elektronorbitale ('n metaalatoom het vyf d-orbitale). Wanneer 'n ligand naby die metaalioon kom, is die ongepaarde elektrone nader aan sommige d orbitale as dié van ander d orbitale van die metaalioon. Dit veroorsaak 'n verlies aan degenerasie. En ook, die elektrone in die d orbitale stoot die elektrone van die ligand af (omdat albei negatief gelaai is). Daarom het die d-orbitale wat nader aan die ligand is, hoë energie as dié van ander d-orbitale. Dit lei tot die verdeling van d orbitale in hoë-energie d orbitale en lae energie d orbitale, gebaseer op die energie.
Sommige faktore wat hierdie verdeling beïnvloed, is; aard van die metaalioon, die oksidasietoestand van metaalioon, die rangskikking van ligande rondom die sentrale metaalioon en die aard van ligande. Na die verdeling van hierdie d orbitale gebaseer op energie, staan die verskil tussen die hoë en lae energie d orbitale bekend as 'n kristal-veld splitsingsparameter (∆okt vir oktaëdriese komplekse).
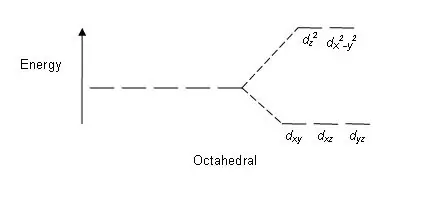
Figuur 01: Splitsingspatroon in oktaëdriese komplekse
Splitpatroon: Aangesien daar vyf d-orbitale is, vind die splitsing plaas in 'n verhouding van 2:3. In oktaëdrale komplekse is twee orbitale in die hoë energievlak (gesamentlik bekend as 'bv'), en drie orbitale is in die laer energievlak (gesamentlik bekend as t2g). In tetraëdriese komplekse kom die teenoorgestelde voor; drie orbitale is in die hoër energievlak en twee in die laer energievlak.
Wat is Strong Ligand?
'n Sterk ligand of 'n sterk veldligand is 'n ligand wat tot 'n hoër kristalveldsplitsing kan lei. Dit beteken, die binding van 'n sterk veldligand veroorsaak 'n groter verskil tussen die hoër en laer energievlak orbitale. Voorbeelde sluit in CN- (sianiedligande), NO2- (nitroligand) en CO (karboniel) ligande).
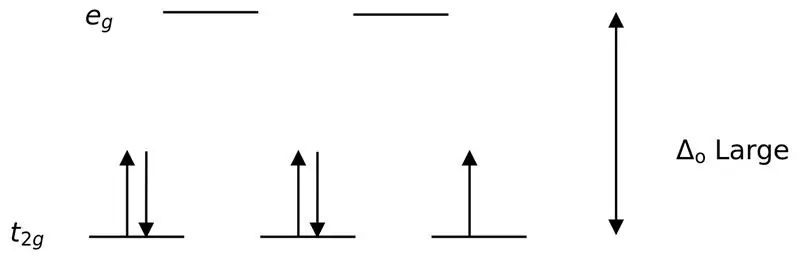
Figuur 02: Lae Spin-verdeling
In die vorming van komplekse met hierdie ligande, word die laer-energie-orbitale (t2g) eers heeltemal met elektrone gevul voordat dit na enige ander hoë-energievlak-orbitale gevul word (bv.). Die komplekse wat op hierdie manier gevorm word, word "lae spin komplekse" genoem.
Wat is swak ligand?
'n Swak ligand of 'n swak veld ligand is 'n ligand wat kan lei tot 'n laer kristal veld splitsing. Dit beteken, die binding van 'n swakveldligand veroorsaak 'n laer verskil tussen die hoër en laer energievlakorbitale.
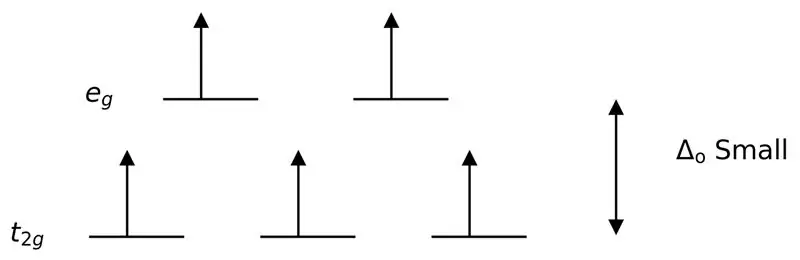
Figuur 3: Hoë Spin-verdeling
In hierdie geval, aangesien die lae verskil tussen die twee orbitale vlakke afstotings tussen elektrone in daardie energievlakke veroorsaak, kan die hoër-energie-orbitale maklik met elektrone gevul word in vergelyking met dié in lae-energie-orbitale. Die komplekse wat met hierdie ligande gevorm word, word "hoë spin komplekse" genoem. Voorbeelde van swakveldligande sluit in I- (jodiedligand), Br- (bromiedligand), ens.
Wat is die verskil tussen sterk ligand en swak ligand?
Sterk Ligand vs Swak Ligand |
|
| 'n Sterk ligand of 'n sterk-veldligand is 'n ligand wat tot 'n hoër kristalveldsplitsing kan lei. | 'n Swak ligand of 'n swak veld ligand is 'n ligand wat kan lei tot 'n laer kristal veld splitsing. |
| Teorie | |
| Die splitsing na binding van 'n sterk veldligand veroorsaak 'n groter verskil tussen die hoër en laer energievlak orbitale. | Die splitsing van orbitale na binding van 'n swak veldligand veroorsaak 'n laer verskil tussen die hoër en laer energievlak orbitale. |
| Kategorie | |
| Die komplekse wat met sterk veldligande gevorm word, word "lae spin komplekse" genoem. | Die komplekse wat met swakveldligande gevorm word, word "hoëspinkomplekse" genoem. |
Opsomming - Sterk Ligand vs Swak Ligand
Sterk ligande en swak ligande is anione of molekules wat die verdeling van d orbitale van 'n metaalioon in twee energievlakke veroorsaak. Die verskil tussen sterk ligande en swak ligande is dat die splitsing na binding van 'n sterkveldligand 'n hoër verskil tussen die hoër en laer energievlak orbitale veroorsaak, terwyl die splitsing van orbitale na binding van 'n swakveldligand 'n laer verskil tussen die hoër en laer energievlak veroorsaak. energievlak orbitale.






