- Outeur Alex Aldridge aldridge@what-difference.com.
- Public 2023-12-17 13:31.
- Laas verander 2025-06-01 07:36.
Sleutelverskil - Alifatiese vs Aromatiese koolwaterstowwe
Kom ons kyk eers kortliks watter koolwaterstowwe die verskil tussen alifatiese en aromatiese koolwaterstowwe bespreek. Koolwaterstowwe is die organiese verbindings wat koolstof- en waterstofatome in hul struktuur bevat. Die belangrikste verskil tussen alifatiese en aromatiese koolwaterstowwe is dat alifatiese koolwaterstowwe nie 'n gekonjugeerde bindingstelsel bevat nie, terwyl aromatiese koolwaterstowwe 'n gekonjugeerde bindingstelsel bevat. Beide hierdie molekules word egter as organiese verbindings beskou.
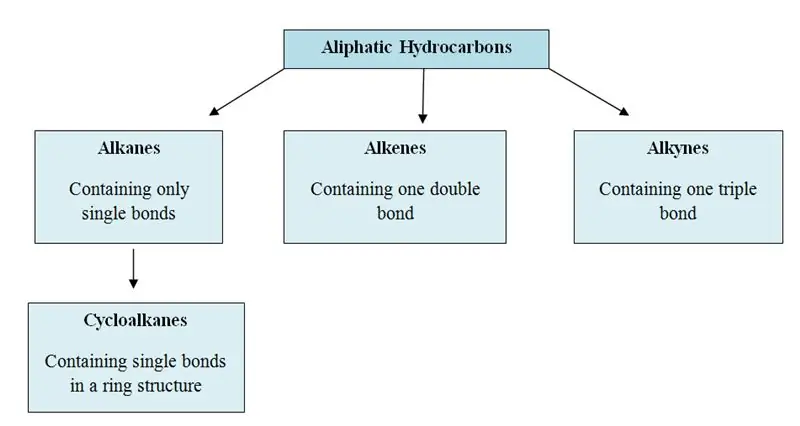
Wat is alifatiese koolwaterstowwe?
Alifatiese koolwaterstowwe is die organiese molekules wat koolstof (C) en waterstof (H) atome in hul struktuur bevat; in reguit kettings, vertakte kettings of nie-aromatiese ringe. Alifatiese koolwaterstowwe kan in drie hoofgroepe gekategoriseer word; alkane, alkene en alkyne.
Wat is aromatiese koolwaterstowwe?
Aromatiese koolwaterstowwe staan soms bekend as "arenes" of "arielkoolwaterstowwe". Die meeste aromatiese koolwaterstowwe bevat 'n benseenring in hul struktuur; maar daar is nie-benseen aromatiese koolwaterstowwe genoem heteroarene, wat die "Huckle se reël" volg (Sikliese ringe wat die Huckle se reël volg het 4n+2 aantal π-elektrone; waar n=0, 1, 2, 3, 4, 5, 6). Sommige aromatiese koolwaterstowwe het meer as een ring; hulle word polisikliese aromatiese koolwaterstowwe genoem.
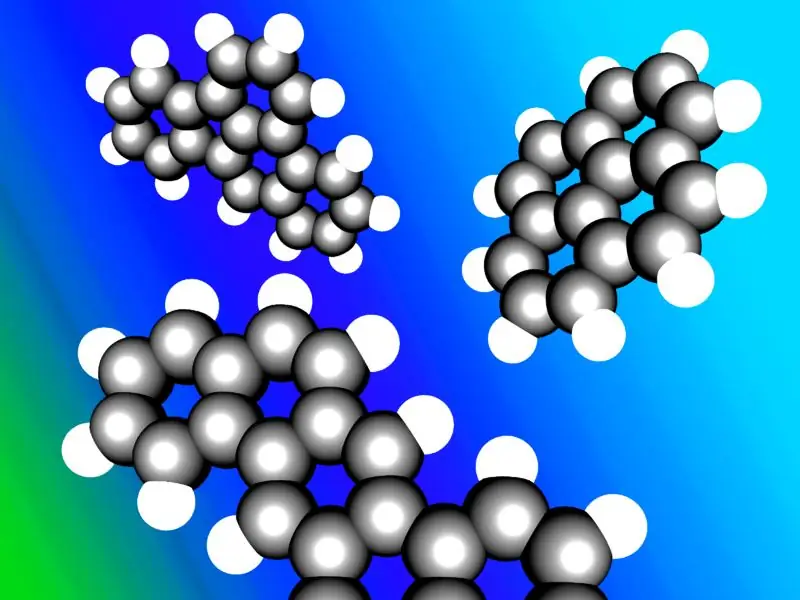
'n Illustrasie van tipiese polisikliese aromatiese koolwaterstowwe.
Wat is die verskil tussen alifatiese en aromatiese koolwaterstowwe?
Struktuur van alifatiese en aromatiese koolwaterstowwe
Alifatiese koolwaterstowwe: Hulle het reguit kettings, vertakte kettings of nie-aromatiese ringe in hul struktuur. Hierdie groep het beide versadigde en onversadigde koolwaterstowwe. Alkane is versadigde koolwaterstowwe, alkene en alkyne is onversadigde koolwaterstowwe.
reguit kettings:
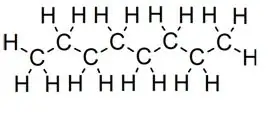
Oktaan
handelsmerkkettings:
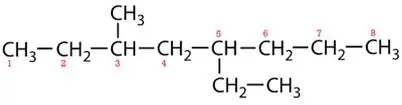
5-etiel-3-metieloktaan

2-metiel-3-pentence
Nie-aromatiese ringe:
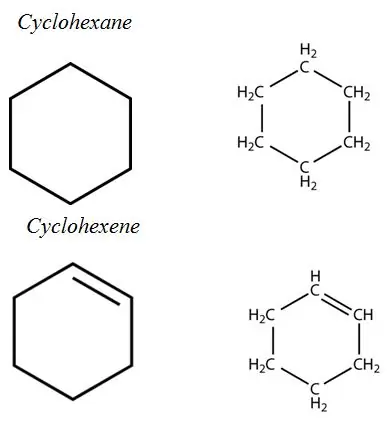
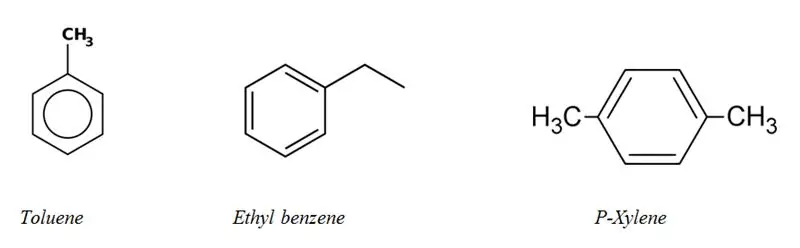
Aromatiese koolwaterstowwe: Aromatiese koolwaterstowwe het 'n aromatiese ringstelsel in hul struktuur. Hulle is almal onversadigde koolwaterstowwe, maar relatief stabiel as gevolg van die gekonjugeerde bindingsisteem.
kategorieë van alifatiese en aromatiese koolwaterstowwe
Alifatiese koolwaterstowwe:
Daar is drie hoofgroepe in alifatiese koolwaterstowwe; alkane, alkene en alkyne. Hulle staan ook bekend as alliel koolwaterstowwe.
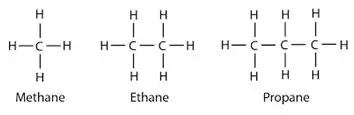
Alkane: In alkane word koolstof- en waterstofatome deur enkelbindings aan mekaar gebind. Hulle het nie veelvuldige bindings nie. Alkane vorm ringstrukture, hulle word sikloalkane genoem.
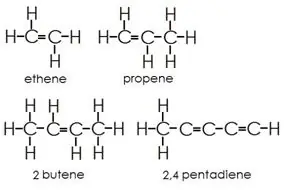
Alkene: Hierdie groep bevat beide enkel- en dubbelbindings tussen koolstofatome. Waterstof- en koolstofatome vorm altyd enkelbindings.
Alkyne: Alkyne het drievoudige bindings tussen koolstofatome bykomend tot enkelbindings.
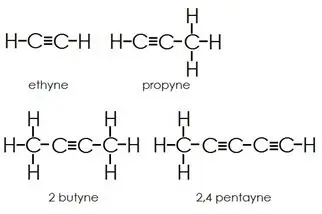
Aromatiese koolwaterstowwe:
Die meeste van die aromatiese koolwaterstowwe bevat ten minste een benseenring in hul struktuur. Maar daar is min nie-benseen aromatiese koolwaterstowwe, hulle word "heteroarene" genoem. Aromatiese koolwaterstowwe word "ariel" koolwaterstowwe genoem.
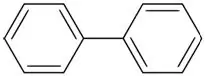
Bifenyl ('n Aromatiese koolwaterstof met twee benseenringe)
Bindpatroon van alifatiese en aromatiese koolwaterstowwe
Alifatiese koolwaterstowwe:
In alifatiese koolwaterstowwe; enkel-, dubbel- of drievoudige bindings kan enige plek in die molekule bestaan. Soms kan daar verskeie strukture vir een molekulêre formule wees deur die posisie van die meervoudige binding(s) te verander. Hierdie molekules het 'n gelokaliseerde elektronstelsel.
Aromatiese koolwaterstowwe:
In aromatiese koolwaterstowwe het hulle 'n alternatiewe enkel- en dubbelbindingsisteem om 'n gekonjugeerde bindingstelsel te vorm om sommige elektrone te delokaliseer. (Gedelokaliseerde elektrone kan van een binding na 'n ander beweeg).
Reaksies van alifatiese en aromatiese koolwaterstowwe
Alifatiese koolwaterstowwe:
Versadigde koolwaterstowwe ondergaan substitusiereaksies; onversadigde koolwaterstowwe bereik die stabiliteit deur addisiereaksie. Maar sommige reaksies vind plaas onder gekontroleerde toestande sonder om veelvuldige bindings te verbreek.
Aromatiese koolwaterstowwe:
Aromatiese koolwaterstowwe is onversadig, maar het 'n stabiele gekonjugeerde elektronsisteem, sodat hulle meer vatbaar is vir substitusiereaksies eerder as addisiereaksies.
Beeld met vergunning: “Polycyclic Aromatic Hydrocarbons” deur Inductiveload - Eie werk deur oplaaier, Accelrys DS Visualizer. (Publieke Domein) via Commons






