- Outeur Alex Aldridge aldridge@what-difference.com.
- Public 2023-12-17 13:31.
- Laas verander 2025-06-01 07:36.
Die sleutelverskil tussen eerste- en tweede-orde-reaksies is dat die tempo van eerste-orde-reaksies afhang van die eerste mag van die reaktantkonsentrasie in die tempovergelyking, terwyl die tempo van tweede-orde reaksies afhang van die tweede mag van die konsentrasie term in die tempovergelyking.
Die volgorde van 'n reaksie is die som van die magte waartoe die reaktantkonsentrasies in die tempowetvergelyking verhoog word. Daar is verskeie vorme van reaksies volgens hierdie definisie; nul-orde reaksies (hierdie reaksies hang nie af van die konsentrasie reaktante nie), eerste orde reaksies en tweede orde reaksies.
Wat is eerste bestelling-reaksies?
Eerste-orde reaksies is chemiese reaksies waarvan die reaksietempo afhang van die molêre konsentrasie van een van die reaktante wat by die reaksie betrokke is. Daarom, volgens die bogenoemde definisie vir die volgorde van reaksie, sal die som van die magte waartoe die reaktantkonsentrasies verhoog word in die tempowetvergelyking altyd 1 wees. Daar kan óf 'n enkele reaktant wees wat aan hierdie reaksies deelneem. Dan bepaal die konsentrasie van daardie reaktant die tempo van die reaksie. Maar soms is daar meer as een reaktante wat aan hierdie reaksies deelneem, dan sal een van hierdie reaktante die tempo van die reaksie bepaal.
Kom ons kyk na 'n voorbeeld om hierdie konsep te verstaan. In die ontbindingsreaksie van N2O5, vorm dit NO2 en O 2 gasse as produkte. Aangesien dit net een reaktant het, kan ons die reaksie en die tempovergelyking soos volg skryf.
2N2O5(g) → 4NO2(g) + O 2(g)
Rate=k[N2O5(g)]m
Hier is k die tempokonstante vir hierdie reaksie en m is die volgorde van die reaksie. Daarom, uit eksperimentele bepalings, is die waarde van m 1. Dit is dus 'n eerste-orde reaksie.
Wat is tweede orde-reaksies?
Tweede-orde reaksies is chemiese reaksies waarvan die reaksietempo afhang van die molêre konsentrasie van twee van die reaktante of die tweede mag van een reaktant wat by die reaksie betrokke is. Daarom, volgens die bogenoemde definisie vir volgorde van reaksie, sal die som van die magte waartoe die reaktantkonsentrasies verhoog word in die tempowetvergelyking altyd 2 wees. As daar twee reaktante is, sal die reaksietempo afhang van die eerste mag van die konsentrasie van elke reaktant.
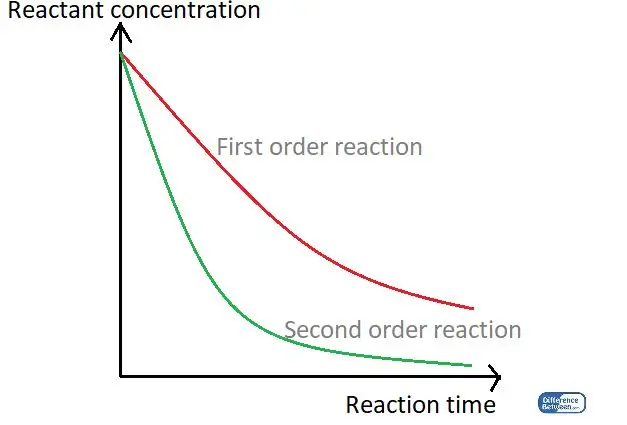
Figuur 01: 'n Grafiek wat die twee tipes reaksieorde vergelyk deur hul reaksietyd en die reaktantkonsentrasie te gebruik.
As ons die konsentrasie van 'n reaktant met 2 keer verhoog (as daar twee reaktante in die tempovergelyking is), dan neem die reaksietempo met 4 keer toe. Kom ons kyk byvoorbeeld na die volgende reaksie.
2A → P
Hier is A 'n reaktant en P is die produk. As dit dan 'n tweede-orde reaksie is, is die tempovergelyking vir hierdie reaksie soos volg.
Koers=k[A]2
Maar vir 'n reaksie met twee verskillende reaktante soos volg;
A + B → P
Rate=k[A]1[B]1
Wat is die verskil tussen eerste en tweede orde reaksies?
Eerste-orde reaksies is chemiese reaksies waarvan die reaksietempo afhang van die molêre konsentrasie van een van die reaktante wat by die reaksie betrokke is. As ons dus die konsentrasie van die reaktant met 2 keer verhoog, neem die reaksietempo met 2 keer toe. Tweede-orde reaksies is chemiese reaksies waarvan die reaksietempo afhang van die molêre konsentrasie van twee van die reaktante of die tweede mag van een reaktant wat by die reaksie betrokke is. As ons dus die konsentrasie van die reaktant met 2 keer verhoog, neem die reaksietempo met 4 keer toe. Die onderstaande infografika bied die verskil tussen eerste en tweede orde reaksies in 'n tabelvorm aan.

Opsomming - Eerste vs Tweede Orde-reaksies
Daar is drie hooftipes reaksies volgens die volgorde van die reaksie; nul-orde, eerste orde en tweede orde reaksies. Die sleutelverskil tussen eerste- en tweede-orde-reaksies is dat die tempo van 'n eerste-orde reaksie afhang van die eerste mag van die reaktantkonsentrasie in die tempovergelyking, terwyl die tempo van 'n tweede-orde reaksie afhang van die tweede mag van die konsentrasieterm in die koersvergelyking.






